Trabajos de Química
martes, 28 de noviembre de 2017
sábado, 2 de septiembre de 2017
viernes, 5 de mayo de 2017
Mezclas y Soluciones.
El trabajo de este segundo periodo ha tenido la tematica de mezclas y soluciones quimicas, mi presentación la lleve a cabo en el recurso tecnologico "Pow Toon"; espero sea de su completo agrado.
Pueden dar clic a continuacion para re-dirigirse a la página donde está mi animación.
https://www.powtoon.com/online-presentation/eVDkdL1Flxb/?mode=movie#/
https://www.powtoon.com/online-presentation/eVDkdL1Flxb/?mode=movie#/
viernes, 28 de abril de 2017
Línea de Tiempo de la Química Orgánica (PAMA).
A continuación pueden dar clic para poder visualizar más a fondo la linea de tiempo.
La quimica organica a traves de la historia.
jueves, 9 de marzo de 2017
Química Orgánica y Formas Anotrópicas del Carbón
Que estudia la Química Orgánica?
La química orgánica estudia los compuestos de carbono y sus reacciones.
Importancia de la Química Orgánica?
La química orgánica es importante porque gracias a ésta existe todo lo que podemos percibir y sentir a nuestro al rededor, ya que todos los productos orgánicos están presentes en todo lo que nos rodea todo el tiempo; algunos ejemplos acertados son:
•Jabones.
•Jabones.
•Champús.
•Desodorantes.
•Perfumes o Colonias.
•Medicinas.
•Alimentos.
•Prendas de vestir, etc.
Además el conocimiento que nos proporcionan los estudiosos de la quimica orgánica nos permite tener conocimiento del funcionamiento de nuestro organismo, y las sustancias que se generan al sentir emociones ó tener experiencias que no habituamos. Algunas sustancias que genera nuestro cerebro son las siguientes:
•Oxitocina:la molécula del amor, que se genera cuando uno esta enamorado. Esta molécula se genera a partir de el reconocimiento de relaciones de confianza y generosidad entre personas. Es la responsable del amor pasional.
•Dopamina:es llamada la molécula del amor y la ternura. Las personas que son altamente dopamínicas suelen vivir de forma plena y felíz. Al estar enamorados la dopamina aumenta 7.000 veces en su proporción normal y viene acompañada de oxitocina, la responsable de la pasión sexual y de las fenilananinas, las responsables del entusiasmo.
•Fenilananinas: es la molécula responsable del entusiasmo.
•Endorfinas:Estas son sustancias producidas por el propio organismo y son una cura contundente contra el estrés, el dolor, la fatiga, la depresión o la ansiedad.
•Dopamina:Es la molécula que genera adicción a las sensaciones de placer que llevan o conducen a esta. ya sean fumar, beber, estar bajo el efecto de una droga, tener relaciones sexuales, comer, escuchar la música preferida de uno o algo relacionado.
También la química orgánica es importante ya que permite profundizar a cerca de los procesos vitales.
La industria quimíca como lo son las áreas de los pesticidas, herbicidas, incecticidas fármacos, polímeros, ect. juegan un papel muy inportante en la economíoa a nivel mundial e incide mucho en nuestra vida diaria con lo que vienen siendo sus productos.
Cuales son las fuentes de los compuestos orgánicos?
1. Petróleo
Es la primera fuente de compuestos orgánicos. Al destilarlo se pueden obtener compuestos como la gasolina, diesel, gas, aceites, lubricantes, alcohol y otros compuestos utilizados como materia prima en la síntesis de colorantes, polímeros, medicamentos, etc.
2. Carbón
Es la principal materia prima tradicional y la segunda fuente de estas sustancias. Las rocas sedimentarias presionan los materiales orgánicos impidiendo el acceso de aire, con lo cual se forman capas duras, negras, brillantes, constituidas fundamentalmente por carbono, oxígeno, hidrógeno, nitrógeno y algo de azufre. Al destilar la hulla en ausencia de aire a temperaturas de 1000º C a 3000º C, se desprenden sustancias volátiles: gas y alquitrán de hulla, y como residuo se obtiene carbón coque. La hulla está constituida por una mezcla de unos 200 compuestos carbonados, los cuales se utilizan como materia prima en la industria.
Es la primera fuente de compuestos orgánicos. Al destilarlo se pueden obtener compuestos como la gasolina, diesel, gas, aceites, lubricantes, alcohol y otros compuestos utilizados como materia prima en la síntesis de colorantes, polímeros, medicamentos, etc.
2. Carbón
Es la principal materia prima tradicional y la segunda fuente de estas sustancias. Las rocas sedimentarias presionan los materiales orgánicos impidiendo el acceso de aire, con lo cual se forman capas duras, negras, brillantes, constituidas fundamentalmente por carbono, oxígeno, hidrógeno, nitrógeno y algo de azufre. Al destilar la hulla en ausencia de aire a temperaturas de 1000º C a 3000º C, se desprenden sustancias volátiles: gas y alquitrán de hulla, y como residuo se obtiene carbón coque. La hulla está constituida por una mezcla de unos 200 compuestos carbonados, los cuales se utilizan como materia prima en la industria.
3. Organismos animales y vegetales
A partir de estos organismos se obtienen mediante diferentes procesos: vitaminas, hormonas y alcaloides.
A partir de estos organismos se obtienen mediante diferentes procesos: vitaminas, hormonas y alcaloides.
4. Residuos vegetales y animales
Por extracciones y transformaciones sencillas se obtienen muchos compuestos orgánicos. Mediante la fermentación de melazas y mostos se obtienen alcoholes, ácidos, entre otros, por destilación de la madera se obtiene ácido acético, acetona y alcohol etílico.
5. Síntesis orgánica
La síntesis total de un compuesto orgánico requeriría partir de los elementos que lo componen. Sin embargo a partir de ellos se puede obtener compuestos orgánicos simples como la úrea, el metano, metanol, acetileno, ácido acético, etanol y así siguiendo se puede ir construyendo estructuras cada vez más complejas.
6. Gas natural
El gas natural se halla en yacimientos aislados y, en ocasiones, junto al petróleo. De las mezclas de gases se suelen separar, por licuación, los hidrocarburos de tres carbonos en adelante, que son envasados a presión y empleados como combustible, como el propano o el butano.
Compuesto orgánico o molécula orgánica es un compuesto químico que contiene carbono, formando enlaces carbono-carbono y carbono-hidrógeno.
Diferencia entre compuestos orgánicos e inorgánicos:
Mediante 9 Ítems explicaré las diferencias entre los compuestos orgánicos e inorgánicos.
•Composición: Los compuestos orgánicos estan formados de carbono, hidrógeno, nitrógeno y oxígeno. por el otro lado los compuestos inorgánicos se forman con la mayoria de los elementos de la tabla periódica.
•Enlace: En los comuestos orgánicos predomina el enlace covalente. Y en los inorgánicos predomina el enlace iónico.
•Solubilidad: Los compuestos orgánicos son solubles en solventes no polares (que solo pueden disolver sustancias con enlaces covalentes). Y los inorgánicos son solubles en solventes polares (comom lo es el agua, cuyo enlace es ionico).
•Conductividad eléctrica: los compuestos orgánicos no conducen la electricidad cuando están disueltos. Mientra que los compuestos inorgánicos conducen la electricidad al estar disueltos.
•Puntos de ebullición y fusión: Los compuestos orgánicos tienen puntos de fusión ó ebullición relativamente bajos. Por el contrario los compuestos inorgánicos tienen altos puntos de ebullición.
•Estabilidad: los orgánicos son poco estables y se descomponen fácilmente. Los compuestos inorgánicos son muy estables.
•Estructuras: las estructuras de los compuestos orgánicos son de forma compleja y tienen un peso molecular considerablemente alto. En cambio los compuestos inorgánicos son todo lo contrario.
•Velocidad de reacción: Las reacciones de los compuestos orgánicos son lentas. Y las reacciones de los compuestos inorgánicos son casi instantáneas.
•Isometría: Este fenómeno es muy común en los compuestos orgánicos. En los compuestos inorgánicos es poco común ver ese fenómeno.
Características de los compuestos Orgánicos:
•Se forman principalmente por Carbono, Hidrógeno, Oxígeno, Nitrógeno, Fósforo, Azufre y Halógenos.
•El enlace que une sus moléculas es covalente.
•El número que existe de compuestos orgánicos es mayor al número de compuestos inorgánicos.
•Los compuestos orgánicos tienen la capacidad de llevar a cabo la concatenación, que es la capacidad de producir cadenas de carbono.
•Son y se usan como, combustibles.
•Su descomposición es fácil de llevar a cabo mediante el calor.
•Las reacciones que ocurren en estos compuestos ocurren de manera lenta.
•Son sólidos, líquidos o gaseosos bajo punto de fusión.
•Son pocas las soluciones de dichos compuestos que se ionizan y conducen la corriente eléctrica.
•Por lo general son solubles en solventes orgánicos como lo son el alcohol, el cloroformo, el benzeno, y el éter.
Características de los compuestos Inorgánicos:
•Son sólidos solubles en diluyentes como lo es el agua.
•Al ionizarse empiezan a conducir la electricidad.
•En estos compuestos no se da la concatenación.
•Las reacciones que ocurren en los compuestos inorgánicos lo hacen de manera rápida.
•Se forma en composición de todos los elementos de la tabla periódica, menos el carbono.
•Resisten altas temperaturas.
•Son menos los compuestos inorgánicos que los orgánicos.
•Sus puntos de fusión son elevados.
•No se da la isometría en su estructura molecular.
•No suelen arder como lo hacen los compuestos orgánicos.
•El enlace que se da en su estructura molecular es iónico.
El átomo de Carbono
El carbono es uno de los elementos esenciales para la vida, está presente en cualquier forma de vida conocida y es fundamental en la quimica orgánica.
Características:
•Su símbolo es C.
•Su número atómico es 6 y su masa atómica es 12:
lo que significa que tiene en su núcleo 6 protones y 6 neutrones, el cual está rodeado por 6 electrones. Que estan distribuidos 2 electrones en su primer nivel, y 4 en su segundo nivel.
•Es tetravalente:
Significa que tiene 4 electrones en su último nivel y estos le permiten a menudo unirse con otros átomos de carbono formando enlaces covalentes.
•Tiene tres posibles hibridaciones:
Gracias a sus electrones en su capa exterior se pueden unir a otros átomos, lo que le permite formar tres tipos de uniones, las que tienen implicancia en la geometría molecular:
-Simples.
-Dobles.
-Triples.
•Tiene una relativa semejanza con el Silicio:
El carbono es el primer miembro del grupo IV dentro de la tabla periódica de los elementos. Le sigue en este mismo grupo el silicio, que también tiene 4 electrones en su capa más externa. Sin embargo, el silicio no puede formar enlaces múltiples silicio-silicio a causa de la repulsión que genera un mayor número de electrones internos, lo que hace que los átomos no puedan aproximarse lo suficiente.
•Presenta Isótopos:
El carbono tiene solo dos isótopos naturales: el carbono 12, que es el mayoritario (98,90%), y el carbono 13, presente en mínima proporción (1,10%). Además existen trece isótopos inestables cuyos períodos de semidesintegración o vida media van desde los 200 nanosegundos (como en el carbono 22) hasta los 5730 años (como sucede con el carbono 14). El carbono 13 se utiliza en estudios estructurales (sobre todo, de RMN), el carbono 14 se emplea para datar objetos arqueológicos, dada su larguísima vida media.
•Se combina fácilmente:
El carbono se puede combinar tanto con metales como con no metales (ejemplos: carburo de calcio, disulfuro de carbono, cloroformo, etc.). Se estima que hay cerca de 10 millones de compuestos de carbono, muchos de ellos esenciales para la vida.
Farmas Alotrópicas del carbono:
El carbono tiene alrededor de 7 formas alotropicas, que son las siguientes:
•El grafito, cuya estructura es la siguiente:



•El nanotubo de carbono, su estructura es la siguiente:

•El fullereno, su estructura es la siguiente:


•El grafeno, su estructura es la siguiente:


•Nanoespuma de carbono:

Por extracciones y transformaciones sencillas se obtienen muchos compuestos orgánicos. Mediante la fermentación de melazas y mostos se obtienen alcoholes, ácidos, entre otros, por destilación de la madera se obtiene ácido acético, acetona y alcohol etílico.
5. Síntesis orgánica
La síntesis total de un compuesto orgánico requeriría partir de los elementos que lo componen. Sin embargo a partir de ellos se puede obtener compuestos orgánicos simples como la úrea, el metano, metanol, acetileno, ácido acético, etanol y así siguiendo se puede ir construyendo estructuras cada vez más complejas.
6. Gas natural
El gas natural se halla en yacimientos aislados y, en ocasiones, junto al petróleo. De las mezclas de gases se suelen separar, por licuación, los hidrocarburos de tres carbonos en adelante, que son envasados a presión y empleados como combustible, como el propano o el butano.
Compuesto orgánico o molécula orgánica es un compuesto químico que contiene carbono, formando enlaces carbono-carbono y carbono-hidrógeno.
Diferencia entre compuestos orgánicos e inorgánicos:
Mediante 9 Ítems explicaré las diferencias entre los compuestos orgánicos e inorgánicos.
•Composición: Los compuestos orgánicos estan formados de carbono, hidrógeno, nitrógeno y oxígeno. por el otro lado los compuestos inorgánicos se forman con la mayoria de los elementos de la tabla periódica.
•Enlace: En los comuestos orgánicos predomina el enlace covalente. Y en los inorgánicos predomina el enlace iónico.
•Solubilidad: Los compuestos orgánicos son solubles en solventes no polares (que solo pueden disolver sustancias con enlaces covalentes). Y los inorgánicos son solubles en solventes polares (comom lo es el agua, cuyo enlace es ionico).
•Conductividad eléctrica: los compuestos orgánicos no conducen la electricidad cuando están disueltos. Mientra que los compuestos inorgánicos conducen la electricidad al estar disueltos.
•Puntos de ebullición y fusión: Los compuestos orgánicos tienen puntos de fusión ó ebullición relativamente bajos. Por el contrario los compuestos inorgánicos tienen altos puntos de ebullición.
•Estabilidad: los orgánicos son poco estables y se descomponen fácilmente. Los compuestos inorgánicos son muy estables.
•Estructuras: las estructuras de los compuestos orgánicos son de forma compleja y tienen un peso molecular considerablemente alto. En cambio los compuestos inorgánicos son todo lo contrario.
•Velocidad de reacción: Las reacciones de los compuestos orgánicos son lentas. Y las reacciones de los compuestos inorgánicos son casi instantáneas.
•Isometría: Este fenómeno es muy común en los compuestos orgánicos. En los compuestos inorgánicos es poco común ver ese fenómeno.
Características de los compuestos Orgánicos:
•Se forman principalmente por Carbono, Hidrógeno, Oxígeno, Nitrógeno, Fósforo, Azufre y Halógenos.
•El enlace que une sus moléculas es covalente.
•El número que existe de compuestos orgánicos es mayor al número de compuestos inorgánicos.
•Los compuestos orgánicos tienen la capacidad de llevar a cabo la concatenación, que es la capacidad de producir cadenas de carbono.
•Son y se usan como, combustibles.
•Su descomposición es fácil de llevar a cabo mediante el calor.
•Las reacciones que ocurren en estos compuestos ocurren de manera lenta.
•Son sólidos, líquidos o gaseosos bajo punto de fusión.
•Son pocas las soluciones de dichos compuestos que se ionizan y conducen la corriente eléctrica.
•Por lo general son solubles en solventes orgánicos como lo son el alcohol, el cloroformo, el benzeno, y el éter.
Características de los compuestos Inorgánicos:
•Son sólidos solubles en diluyentes como lo es el agua.
•Al ionizarse empiezan a conducir la electricidad.
•En estos compuestos no se da la concatenación.
•Las reacciones que ocurren en los compuestos inorgánicos lo hacen de manera rápida.
•Se forma en composición de todos los elementos de la tabla periódica, menos el carbono.
•Resisten altas temperaturas.
•Son menos los compuestos inorgánicos que los orgánicos.
•Sus puntos de fusión son elevados.
•No se da la isometría en su estructura molecular.
•No suelen arder como lo hacen los compuestos orgánicos.
•El enlace que se da en su estructura molecular es iónico.
El átomo de Carbono
El carbono es uno de los elementos esenciales para la vida, está presente en cualquier forma de vida conocida y es fundamental en la quimica orgánica.
Características:
•Su símbolo es C.
•Su número atómico es 6 y su masa atómica es 12:
lo que significa que tiene en su núcleo 6 protones y 6 neutrones, el cual está rodeado por 6 electrones. Que estan distribuidos 2 electrones en su primer nivel, y 4 en su segundo nivel.
•Es tetravalente:
Significa que tiene 4 electrones en su último nivel y estos le permiten a menudo unirse con otros átomos de carbono formando enlaces covalentes.
•Tiene tres posibles hibridaciones:
Gracias a sus electrones en su capa exterior se pueden unir a otros átomos, lo que le permite formar tres tipos de uniones, las que tienen implicancia en la geometría molecular:
-Simples.
-Dobles.
-Triples.
•Tiene una relativa semejanza con el Silicio:
El carbono es el primer miembro del grupo IV dentro de la tabla periódica de los elementos. Le sigue en este mismo grupo el silicio, que también tiene 4 electrones en su capa más externa. Sin embargo, el silicio no puede formar enlaces múltiples silicio-silicio a causa de la repulsión que genera un mayor número de electrones internos, lo que hace que los átomos no puedan aproximarse lo suficiente.
•Presenta Isótopos:
El carbono tiene solo dos isótopos naturales: el carbono 12, que es el mayoritario (98,90%), y el carbono 13, presente en mínima proporción (1,10%). Además existen trece isótopos inestables cuyos períodos de semidesintegración o vida media van desde los 200 nanosegundos (como en el carbono 22) hasta los 5730 años (como sucede con el carbono 14). El carbono 13 se utiliza en estudios estructurales (sobre todo, de RMN), el carbono 14 se emplea para datar objetos arqueológicos, dada su larguísima vida media.
•Se combina fácilmente:
El carbono se puede combinar tanto con metales como con no metales (ejemplos: carburo de calcio, disulfuro de carbono, cloroformo, etc.). Se estima que hay cerca de 10 millones de compuestos de carbono, muchos de ellos esenciales para la vida.
Farmas Alotrópicas del carbono:
El carbono tiene alrededor de 7 formas alotropicas, que son las siguientes:
•El grafito, cuya estructura es la siguiente:
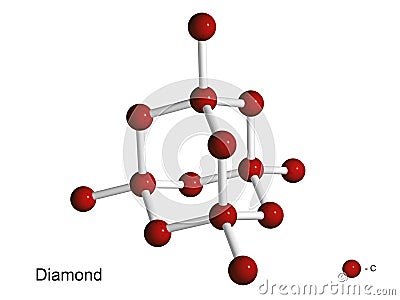
•El diamante, su estructura es la siguiente:

•El nanotubo de carbono, su estructura es la siguiente:
•El fullereno, su estructura es la siguiente:
•Nanoespuma de carbono:
jueves, 2 de marzo de 2017
Presentación sobre el: Premio Nobel de Química en el año 2016 y Los 4 Elementos químicos añadidos a la tabla periódica en el año 2016
Premio Nobel de Química 2016 y Los 4 últimos elementos agregados a la tabla periódica en el año 2016.
Espero y sea de su completo agrado.
Espero y sea de su completo agrado.
Suscribirse a:
Entradas (Atom)
